Azometin ilidlari

Azometin ilidlari azotga asoslangan 1,3-dipollar boʻlib, karbanion yonidagi iminium ionidan iborat. Ular pirolidinlar va pirrolinlarni oʻz ichiga olgan besh aʼzoli heterosikllarni hosil qilish uchun 1,3-dipolyar siklodlanish reaksiyalarida qoʻllanadi.[1][2][3] Bu reaksiyalar yuqori darajada stereo- va regioselektivdir va toʻrtta yangi qoʻshni stereosentrlarni hosil qilish potentsialiga ega. Shunday qilib, azometin ilidlari umumiy sintezda va chiral ligandlar va farmatsevtika vositalarining shakllanishida yuqori foydalilikka ega. Azometin ilidlari koʻplab manbalardan, shu jumladan aziridinlar, iminlar va iminyumlardan hosil boʻlishi mumkin. Ular koʻpincha in situ hosil boʻladi va darhol dipolarofillar bilan reaksiyaga kirishadi.
Tuzilishi
[tahrir | manbasini tahrirlash]Quyidagi rezonans tuzilmalari 1,3-dipol hissasini koʻrsatadi, bunda azotga qoʻshni ikkita uglerod atomi manfiy yoki musbat zaryadga ega.[1] Azometin ylidlarining eng keng tarqalgan ifodasi azot musbat zaryadlangan va manfiy zaryad ikki uglerod atomi oʻrtasida taqsimlangan. Turli rezonans tuzilmalarining nisbiy hissasi har bir atomdagi oʻrinbosarlarga bogʻliq. Elektron tortib oluvchi oʻrinbosarlarni oʻz ichiga olgan uglerod koʻproq qisman manfiy zaryadga ega boʻladi, chunki yaqin atrofdagi elektronni tortib oluvchi guruh manfiy zaryadni barqarorlashtirish qobiliyatiga ega.

1,3-dipolya engr siklo yuklanish reaksiyalari mahsulotida har xil stereokimyoga olib keladigan uch xil ilid shakllari mumkin. W shaklidagi, U shaklidagi va S shaklidagi ylidalar mumkin.[1] R oʻrnini bosuvchi moddalar bir tomonda joylashgan W va U shaklidagi ylidlar sinsiklyajlanish mahsulotlarini hosil qiladi, S shaklidagi ylidlar esa anti -mahsulotlarga olib keladi. Quyidagi misollarda R3 oʻrnini bosuvchi mahsulotda tugashi uning sterik va elektron tabiatiga bogʻliq boʻladi (qarang: 1,3 dipolyar siklo yuklanishning regioselektivligi). Tsikloadlanish mahsulotidagi R1 va R2 ning stereokimyosi dipoldan olingan. R3 ning stereokimyosi dipolarofildan olingan – agar dipolarofil mono-almashtirilgandan (va prokiraldan) koʻp boʻlsa, mahsulotga toʻrttagacha yangi stereosentrlar paydo boʻlishi mumkin.

Avlod
[tahrir | manbasini tahrirlash]Aziridinlardan
[tahrir | manbasini tahrirlash]Azometin ilidlari aziridinlarning halqa ochilishi natijasida hosil boʻlishi mumkin.[4][5] Vudvord-Xoffman qoidalariga koʻra, termal toʻrt elektronli halqaning ochilishi konrotatsion jarayon orqali davom etadi, fotokimyoviy reaksiya esa disrotatsiondir.

Ushbu halqani ochish reaksiyasida torkselektivlik muammosi mavjud. Elektromanfiy oʻrinbosarlar tashqi tomonga, azotdagi R oʻrnini bosuvchi tomonga aylanishni afzal koʻradi, elektropozitiv oʻrinbosarlar esa ichkariga aylanishni afzal koʻradi.[6]
Eʼtibor bering, aziridinlar bilan halqaning ochilishi boshqa 1,3-dipolga olib kelishi mumkin, bunda C-N aloqasi (C-C aloqasi oʻrniga) uziladi.[7]
Aldegidning amin bilan kondensatsiyasi bilan
[tahrir | manbasini tahrirlash]
Azometin ilidlarini hosil qilishning eng oson usullaridan biri aldegidni amin bilan kondensatsiya qilishdir. Agar amin alfa-uglerodda, masalan, ester kabi elektronni tortib oluvchi guruhni oʻz ichiga olsa, deprotonatsiya tezda sodir boʻladi. Ushbu usuldan foydalanishning mumkin boʻlgan kamchiligi shundaki, ester tsiklik yuklanish mahsulotida tugaydi. Shu bilan bir qatorda, dekarboksilasyon yoʻli bilan siklo yuklash jarayonida osongina olib tashlanishi mumkin boʻlgan karboksilik kislotadan foydalanish mumkin.[8]
Iminlar va iminiumlardan
[tahrir | manbasini tahrirlash]
Azometin ilidlari bevosita iminiumlarning deprotonatsiyasi orqali ham hosil boʻlishi mumkin.
N -metalllash orqali
[tahrir | manbasini tahrirlash]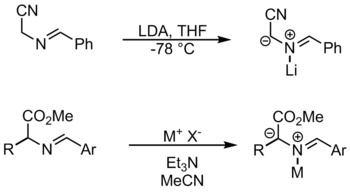
Ushbu reaksiyada ishlatiladigan metall reagentlar orasida lityum bromid va kumush asetat mavjud.[1] Ushbu usulda metall deprotonatsiya uchun substratni faollashtirish uchun azotga muvofiqlashadi. Iminlardan azometin ilidlarini hosil qilishning yana bir usuli prototropiya va alkillanishdir.
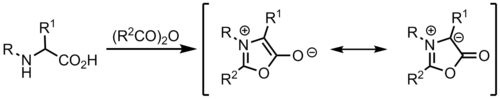
Munchnonesdan
[tahrir | manbasini tahrirlash]Ilidlar mezoionik geterosikllar boʻlgan munchnonlardan hosil boʻlishi mumkin va tsiklik azometin ylidlari vazifasini bajaradi.[9]
1,3-dipolyar siklo yuklanish reaksiyalari
[tahrir | manbasini tahrirlash]
1,3-dipolning -tizimga ega boʻlgan boshqa tsiklik yuklanish reaksiyalarida boʻlgani kabi, azometin ilid yordamida 1,3- dipolyar siklodlanish olti elektronli jarayondir. Vudvord-Xoffman qoidalariga koʻra, bu qoʻshimcha dipol va dipolarofilga nisbatan suprafasialdir. Reaksiya odatda muvofiqlashtirilgan deb qaraladi, unda ikkita uglerod-uglerod aloqasi bir vaqtning oʻzida, lekin asinxron ravishda hosil boʻladi. Biroq, dipol va dipolarofilning tabiatiga qarab, diradikal yoki zvitterionik oraliq mahsulotlar mumkin.[10] Diels-Alder izoelektronik reaksiyasida boʻlgani kabi, endo mahsulot odatda maʼqul keladi. Ushbu reaksiyalarda azometin ylid odatda HOMO va elektron yetishmaydigan dipolarofil LUMO boʻladi, lekin faollashtirilmagan -tizimlari bilan sikllanish reaksiyalari, ayniqsa sikllanish molekulyar boʻlganda sodir boʻlishi maʼlum.[11] 1,3-dipolyar tsiklik yuklanishlarning chegara molekulyar orbital nazariyasi muhokamasi uchun 1,3-dipolyar siklo yuklanish#Frontier molekulyar orbital nazariyasiga qarang.
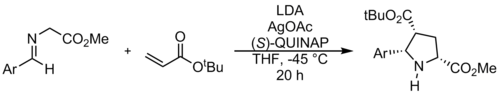
Azometin ilidlarining 1,3-dipolyar siklodlanish reaksiyalari odatda pirolidinlar yoki pirrolinlar hosil qilish uchun dipolarofillar sifatida alkenlar yoki alkinlardan foydalanadi. Azometin ilidning alken bilan reaksiyasi yuqorida koʻrsatilgan va natijada pirolidin hosil boʻladi.[12] Bunday reaksiyalar Ullazinni sintez qilish uchun ishlatilishi mumkin.[13] Dipolarofillar odatda -toʻyinmagan karbonil birikmalari boʻlsa-da, dipolarofillarning yangi turlarini yaratishda soʻnggi paytlarda koʻplab yutuqlar mavjud.[14]
Agar dipol va dipolarofil bir molekulaning bir qismi boʻlsa, molekula ichidagi sikllanish reaksiyasi sezilarli murakkablikdagi politsiklik mahsulotga olib kelishi mumkin.[1] Agar dipolarofil dipolning uglerodiga bogʻlangan boʻlsa, birlashtirilgan velosiped hosil boʻladi. Agar u azotga bogʻlangan boʻlsa, koʻprikli tuzilish paydo boʻladi. Reaksiyaning molekulyar tabiati regioselektivlik koʻpincha cheklanganligi sababli ham foydali boʻlishi mumkin. Intramolekulyar reaksiyalarning yana bir afzalligi shundaki, dipolarofilda elektron tanqisligi boʻlishi shart emas – elektronga boy, alkil oʻrnini bosuvchi dipolarofillar bilan sikllanish reaksiyalarining koʻplab misollari, shu jumladan quyida koʻrsatilgan martinel kislotasi sintezi haqida xabar berilgan.
Sikl yuklamalarning stereoselektivligi
[tahrir | manbasini tahrirlash]Dipolning stereokimyosi yoʻqolgan yoki mavjud boʻlmagan 1,3-dipolyar siklodlanish reaksiyalaridan farqli oʻlaroq, azometin ilidlari oʻzlarining stereokimyosini saqlab qolishga qodir. Bu, odatda, aziridinning halqasini ochish va keyinchalik stereokimyo siljishidan oldin dipolarofil tomonidan tutilishi orqali amalga oshiriladi.
Boshqa 1,3-dipolyar siklo yuklanish reaksiyalari singari, azometin ilid siklo yuklanishi ham endo yoki ekzo mahsulot hosil qilishi mumkin. Ushbu selektivlikni metall kataliz yordamida sozlash mumkin.[15][16]
Enantioselektiv sintez
[tahrir | manbasini tahrirlash]Xiral katalizatorlar yordamida azometin ilidlarining enantioselektiv siklo yuklanishi birinchi marta 1991-yilda Allway va Grigg tomonidan olib borilgan ilmiy ishda tasvirlangan[17] Ushbu kuchli usul Jørgensen va Zhang tomonidan yanada ishlab chiqilgan. Bu reaksiyalar odatda rux, kumush, mis, nikel va kaltsiy komplekslaridan foydalanadi.
Xiral fosfin katalizatorlari yordamida enantiomerik jihatdan sof spiroindolinonlar sintezlanishi mumkin. Gong va boshqalar tomonidan tasvirlangan usul. elektron effektlarga amal qilmaydigan kutilmagan regiokimyoviy natijaga olib keladi. Bu katalizator bilan qulay pi stacking bilan bogʻliq.[18]
Boshqa reaksiyalar
[tahrir | manbasini tahrirlash]Elektrotsikllanishlar
[tahrir | manbasini tahrirlash]Konjugatsiyalangan azometin ylidlari [1,5]- va [1,7]- elektrotsikllanishga qodir.[19] Quyida difeniletenil bilan almashtirilgan azometin ilidning [1,7]-elektrotsikllanishiga misol keltirilgan. Ushbu konrotatsion halqaning yopilishidan soʻng yuza ustki [1,5]-gidrid siljishi sodir boʻladi, bu esa qayta aromatizatsiyalangan mahsulotni beradi. Reaksiya muvaffaqiyatida reaksiyaga kirishuvchi fenil halqaning sterikasi va geometriyasi katta rol oʻynaydi.[20]

Ushbu turdagi elektrotsikllanish natijasida hosil boʻlgan birikmalar Diels-Alder reaksiyalarida fullerenlarga birikmalar biriktirish uchun dien sifatida ishlatilgan.[21]
Sintezda foydalaning
[tahrir | manbasini tahrirlash]Martinel kislotasining umumiy sintezi
[tahrir | manbasini tahrirlash]
Martinel kislotasining umumiy sintezida azometin ilidning faollashtirilmagan alken bilan siklo yuklanishi ishlatilgan. Tsikloadlanish bosqichi ikkita halqani, shu jumladan pirolidinni va ikkita stereosentrni hosil qildi.[22]
Spirotriprostatin B ning umumiy sintezi
[tahrir | manbasini tahrirlash]
Spirotriprostatin B sintezida aminning aldegid bilan kondensatsiyasidan azometin ilid hosil boʻladi. Keyin ilid indolinonda elektron yetishmaydigan alken bilan reaksiyaga kirishadi, natijada spirotsiklik pirolidin va toʻrtta qoʻshni stereosentr hosil boʻladi.[23]
Benzodiazepinonlarning sintezi
[tahrir | manbasini tahrirlash]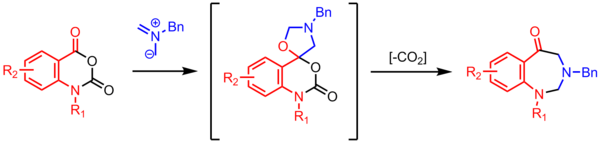
Azometin ilidining karbonil bilan sikllanishi spirotsiklik oksazolidinni hosil qiladi, u CO2 ni yoʻqotib, etti aʼzoli halqa hosil qiladi. Bu yuqori foydali dekarboksilativ koʻp bosqichli reaksiyalar azometin ylid kimyosida keng tarqalgan.[24]
Manbalar
[tahrir | manbasini tahrirlash]- ↑ 1,0 1,1 1,2 1,3 1,4 Coldham, Iain; Hufton, Richard (2005). „Intramolecular Dipolar Cycloaddition Reactions of Azomethine Ylides“. Chemical Reviews. 105-jild, № 7. 2765–2809-bet. doi:10.1021/cr040004c. PMID 16011324.
- ↑ Padwa, Albert „Chapter 3. Azomethine Ylides“, . Synthetic Applications of 1,3-Dipolar Cycloaddition Chemistry Toward Heterocycles and Natural Products, Chemistry of Heterocyclic Compounds: A Series of Monographs, 2003 — 169–252-bet. DOI:10.1002/0471221902.ch3. ISBN 9780471387268.
- ↑ Adrio, Javier; Carretero, Juan C. (2011). „Novel dipolarophiles and dipoles in the metal-catalyzed enantioselective 1,3-dipolar cycloaddition of azomethine ylides“. Chemical Communications. 47-jild, № 24. 6784–6794-bet. doi:10.1039/c1cc10779h. PMID 21472157.
- ↑ Dauban, Philippe; Guillaume, Malik (2009). „A Masked 1,3-Dipole Revealed from Aziridines“. Angewandte Chemie International Edition. 48-jild, № 48. 9026–9029-bet. doi:10.1002/anie.200904941. PMID 19882612.
- ↑ Huisgen, Rolf; Scheer, Wolfgang; Huber, Helmut (1967). „Stereospecific Conversion of cis-trans Isomeric Aziridines to Open-Chain Azomethine Ylides“. Journal of the American Chemical Society. 89-jild, № 7. 1753–1755-bet. doi:10.1021/ja00983a052.
- ↑ Banks, Harold D. (2010). „Torquoselectivity Studies in the Generation of Azomethine Ylides from Substituted Aziridines“. Journal of Organic Chemistry. 75-jild, № 8. 2510–2517-bet. doi:10.1021/jo902600y. PMID 20329779.
- ↑ Cardoso, Ana L.; Pinho e Melo, Teresa M. V. D. (2012). „Aziridines in Formal [3+2]Cycloadditions: Synthesis of Five-Membered Heterocycles“. European Journal of Organic Chemistry. № 33. 6479–6501-bet. doi:10.1002/ejoc.201200406.
- ↑ Huie, Edward (1983). „Intramolecular [3+2]cycloaddition routes to carbon-bridged dibenzocycloheptanes and dibenzazepines“. Journal of Organic Chemistry. 48-jild, № 18. 2994–2997-bet. doi:10.1021/jo00166a011.
- ↑ Padwa, Albert; Gingrich, Henry L.; Lim, Richard (1982). „Regiochemistry of intramolecular munchnone cycloadditions: preparative and mechanistic implications“. Journal of Organic Chemistry. 47-jild, № 12. 2447–2456-bet. doi:10.1021/jo00133a041.
- ↑ Li, Yi; Houk, Kendall N.; González, Javier (1995). „Pericyclic Reaction Transition States“. Accounts of Chemical Research. 20-jild, № 2. 81–90-bet. doi:10.1021/ar00050a004.
- ↑ Heathcock, Clayton H.; Henke, Brad R.; Kouklis, Andrew J. (1992). „Intramolecular 1,3-Dipolar Cycloaddition of Stabilized Azomethine Ylides to Unactivated Dipolarophiles“. Journal of Organic Chemistry. 57-jild, № 56. 7056–7066-bet. doi:10.1021/jo00052a015.
- ↑ Streiber, S. L. (2003). „Catalytic asymmetric [3+2]cycloaddition of azomethine ylides. Development of a versatile stepwise, three-component reaction for diversity-oriented synthesis“. Journal of the American Chemical Society. 125-jild, № 34. 10174–10175-bet. doi:10.1021/ja036558z. PMID 12926931.
- ↑ R. Berger, M. Wagner, X. Feng, K. Müllen. „Polycyclic aromatic azomethine ylides: a unique entry to extended polycyclic heteroaromatics“. 2014. 436–441.doi: 10.1039/C4SC02793K
- ↑ Adrio, Javier; Carreter, Juan C. (2011). „Novel dipolarophiles and dipoles in the metal-catalyzed enantioselective 1,3-dipolar cycloaddition of azomethine ylides“. Chemical Communications. 47-jild, № 24. 6784–6794-bet. doi:10.1039/c1cc10779h. PMID 21472157.
- ↑ Zhang, Xumu; Raghunath, Malati; Gao, Wenzhong (2005). „Cu(I)-Catalyzed Highly Exo-selective and Enantioselective [3+2]Cycloaddition of Azomethine Ylides with Acrylates“. Organic Letters. 7-jild, № 19. 4241–4244-bet. doi:10.1021/ol0516925. PMID 16146397.
- ↑ Fukuzawa, Shin-ichi; Oura, Ichiro; Shimizu, Kenta; Ogata, Kenichi (2010). „Highly Endo-Selective and Enantioselective 1,3-Dipolar Cycloaddition of Azomethine Ylide with α-Enones Catalyzed by a Silver(I)/ThioClickFerrophos Complex“. Organic Letters. 12-jild, № 8. 1752–1755-bet. doi:10.1021/ol100336q. PMID 20232852.
- ↑ Allway, Philip; Grigg, Ronald (1991). „Chiral cobalt(II) and manganese(II) catalysts for the 1,3-dipolar cycloaddition reactions of azomethine ylides derived from arylidene imines of glycine“. Tetrahedron Letters. 32-jild, № 41. 5817–5820-bet. doi:10.1016/S0040-4039(00)93563-9.
- ↑ Gong, Liu-Zhu; Chen, Xiao-Hua; Wei, Qiang; Luo, Shi-Wei; Xiao, Han (2009). „Organocatalytic Synthesis of Spiro[pyrrolidin-3,3′-oxindoles] with High Enantiopurity and Structural Diversity“. Journal of the American Chemical Society. 131-jild, № 38. 13819–13825-bet. doi:10.1021/ja905302f. PMID 19736987.
- ↑ Nedolya, N. A.; Trofimov, B. A. (2013). „[1,7]-Electrocyclization reactions in the synthesis of azepine derivatives“. Chemistry of Heterocyclic Compounds. 49-jild, № 1. 152–176-bet. doi:10.1007/s10593-013-1236-y.
- ↑ Nyerges, Miklós (2006). „1,7-Electrocyclization reactions of stabilized α,β:γ,δ-unsaturated azomethine ylides“. Tetrahedron. 16-jild, № 24. 5725–5735-bet. doi:10.1016/j.tet.2006.03.088.
- ↑ Nierengarten, Jean-François (2002). „An unexpected Diels–Alder reaction on the fullerene core rather than an expected 1,3-dipolar cycloaddition“. Chem. Commun. № 7. 712–713-bet. doi:10.1039/B201122K.
- ↑ Snider, B. B.; Ahn, Y.; O'Hare, S. M. (2001). „Total synthesis of (±)-martinellic acid“. Organic Letters. 3-jild, № 26. 4217–4220-bet. doi:10.1021/ol016884o.
- ↑ Williams, Robert (2003). „Concise, Asymmetric Total Synthesis of Spirotryprostatin A“. Organic Letters. 5-jild, № 17. 3135–3137-bet. doi:10.1021/ol0351910. PMID 12917000.
- ↑ Ryan, John H. (2011). „1,3-Dipolar cycloaddition-decarboxylation reactions of an azomethine ylide with isatoic anhydrides: formation of novel benzodiazepinones“. Organic Letters. 13-jild, № 3. 486–489-bet. doi:10.1021/ol102824k. PMID 21175141.


